服务中心
CUSTOMER SERVICE

本文提出了一种创新的纳米囊泡(NVs)策略,用于增强三阴性乳腺癌(TNBC)免疫治疗的疗效。其中流式细胞术被用于多个关键实验,各实验详细如下:
验证VSVG修饰的纳米囊泡(V-NVs/T+A)是否增强肿瘤细胞的摄取。
用荧光标记(如GFP-VSVG和RFP-TNF-α)的V-NVs/T+A处理4T1和3T3细胞,通过流式检测荧光强分析4T1和3T3细胞NVs/T+A和V-NVs/T+A的细胞摄取情况(图1)。

图1
荧光强度对比:V-NVs/T+A组的荧光强度显著高于未修饰组(NVs/T+A),表明VSVG促进膜融合,提升内化效率。
时间依赖性:荧光强度随时间增加,说明摄取是动态过程。
细胞选择性:V-NVs/T+A在4T1(同源肿瘤细胞)中的荧光强度高于3T3(异源细胞),显示同源靶向性。
评估V-NVs/T+A对免疫微环境的重编程作用。
标记:CD45+(白细胞)、CD11c+(DCs标志)、CD80+/CD86+(成熟DCs)。
实验结果:V-NVs/T+A组CD80+CD86+ DCs比例显著升高(图2,3),表明TNF-α和VSVG协同促进抗原提呈。

图2
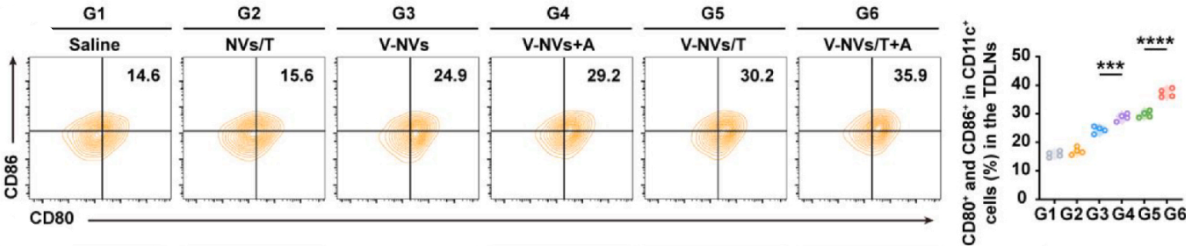 图3
图3
标记:
● M1型(促炎)——CD45+CD11b+F4/80+CD80+。
● M2型(抑炎)——CD45+CD11b+F4/80+CD206+。
实验结果:V-NVs/T+A组M1型比例增加(图4,5),M2型减少(图6),显示免疫微环境从抑炎向促炎转变。
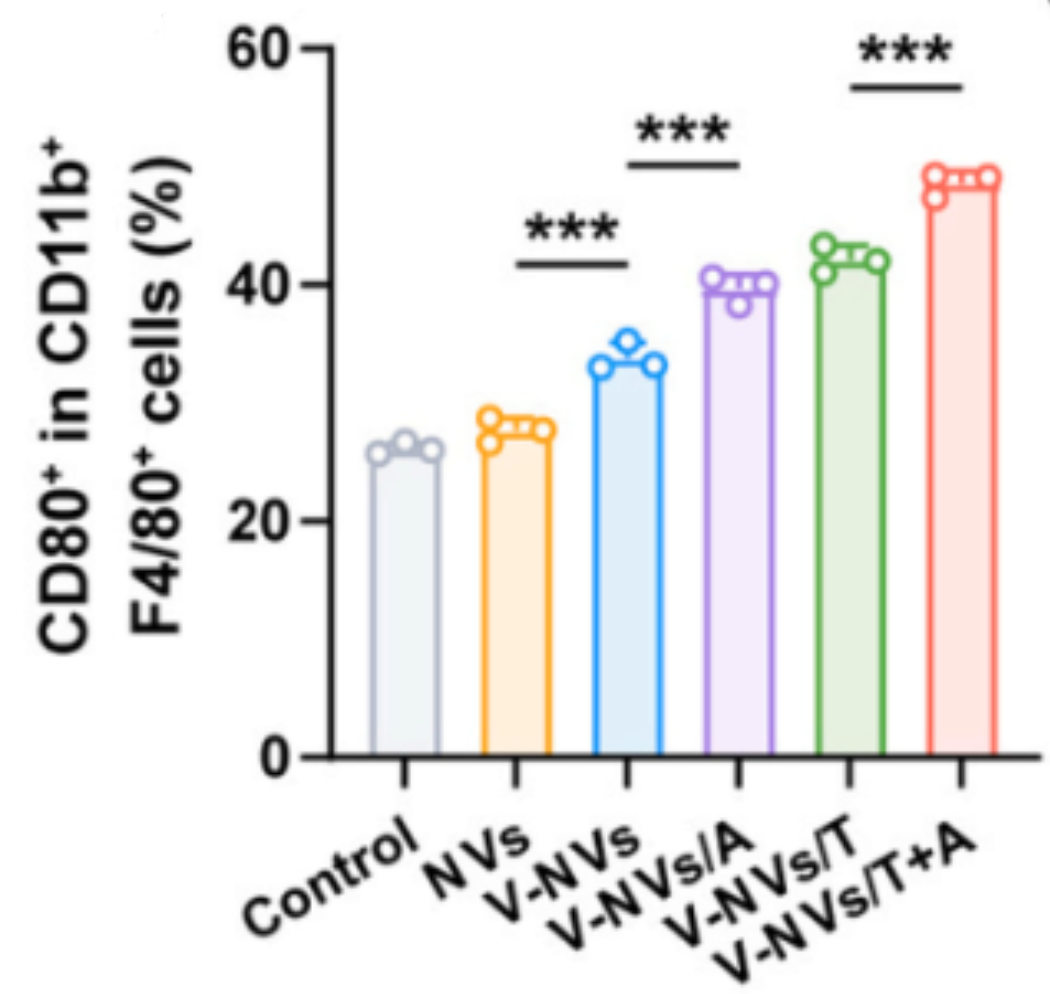
图4
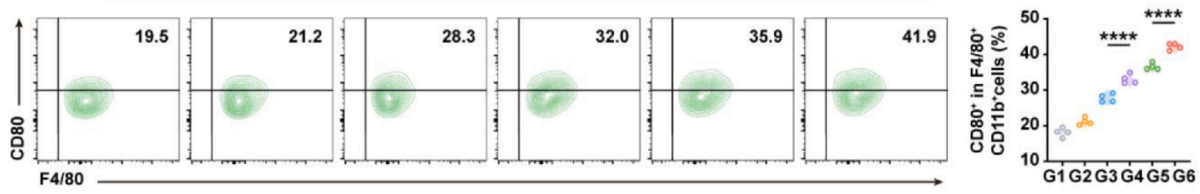 图5
图5
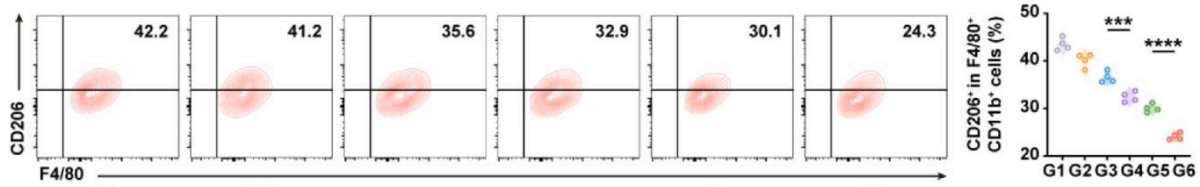 图6
图6
CD8+ T细胞:CD45+CD3+CD8+
实验结果:V-NVs/T+A组浸润增加2.04倍(图7,8),表明细胞毒性免疫应答增强。
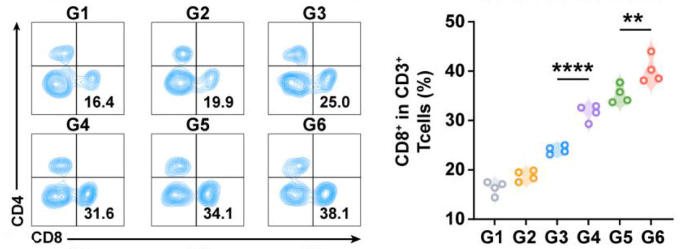
图7
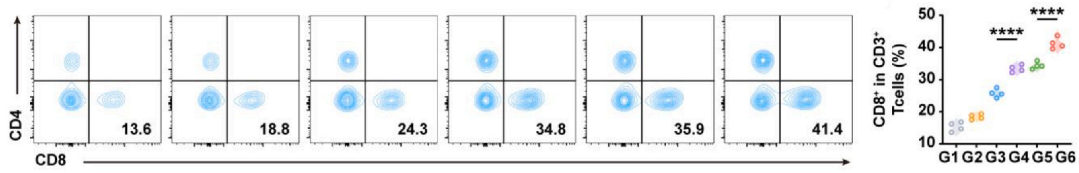 图8
图8
Tregs:CD45+CD3+CD4+Foxp3+
实验结果:V-NVs/T+A组减少54%(图9),表明免疫抑制被逆转。
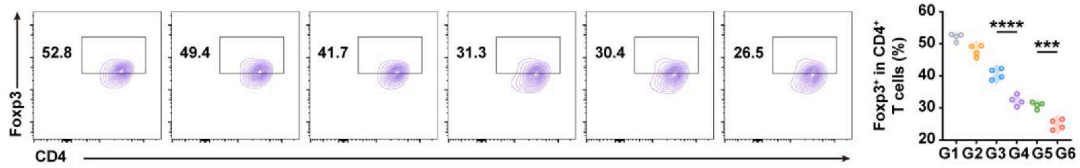 图9
图9
验证TNF-α诱导的凋亡及VSVG/A23187的协同作用。
Annexin V-FITC/PI双染法检测4T1细胞凋亡。
V-NVs/T+A组凋亡率最高,加入TNF-α抑制剂(Z-VAD-FMK)后凋亡减少(图10,11),证实TNF-α依赖的凋亡途径。

图10
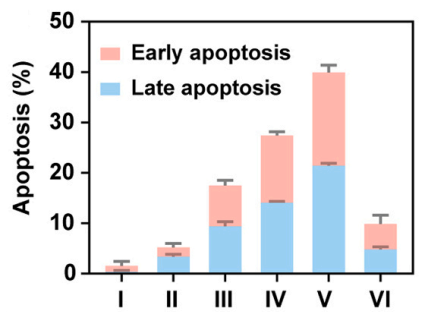
图11
为了进一步验证TNF-α依赖的凋亡的具体路径,WB实验补充了caspase-3的检测,结果显示TNF-α通过激活caspase-3诱导凋亡(图12)。
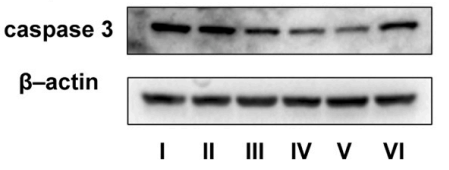
图12
验证A23187通过升高Ca²⁺促进EVs分泌。
Fura-2 AM探针标记细胞内Ca²⁺,流式检测荧光强度。
Ca²⁺水平:Fura-2 AM检测显示A23187(钙离子载体)组细胞内Ca²⁺显著升高(图13)。
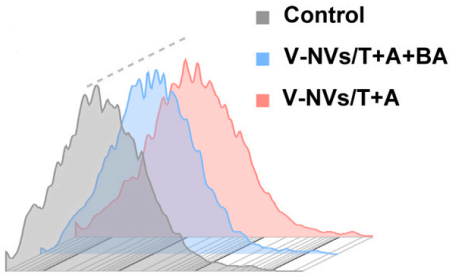
图13
分析全身免疫激活状态。
流式分析CD8+T细胞中TNF-α与IFN-γ的水平。
CD8+T细胞中TNF-α+和IFN-γ+的水平显著升高(图14),这与V-NVs/T+A联合治疗促进的抗肿瘤反应增强趋势一致。该结果表明TNF-α在肿瘤微环境中实现了有效递送与渗透,从而进一步放大了V-NVs/T+A疗法的抗肿瘤功效。
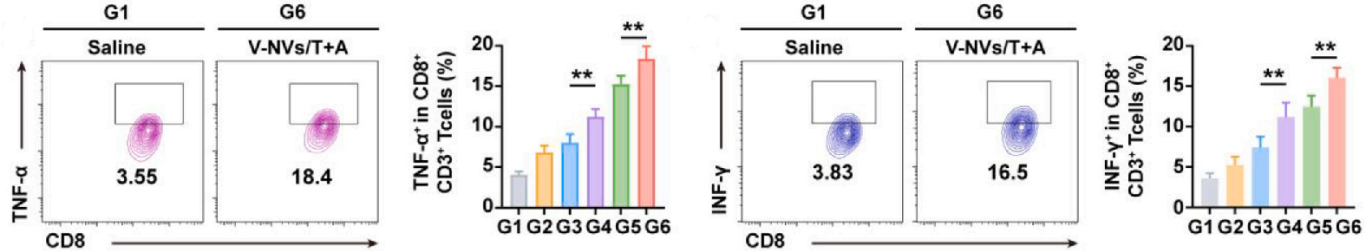
图14
多参数免疫表型分析:通过多色流式同时检测DCs、巨噬细胞、T细胞等亚群,全面评估免疫微环境重塑。
机制验证:
使用抑制剂(如Z-VAD-FMK、BAPTA)明确TNF-α和Ca²⁺的作用。
通过膜融合(VSVG)和内吞抑制实验阐明摄取机制。
体内-体外结合:流式数据与体内疗效(肿瘤抑制、肺转移减少)相互印证,增强结论可靠性。
流式实验在本文中系统验证了V-NVs/T+A的细胞摄取、免疫激活及凋亡诱导机制,核心结论包括:
VSVG促进膜融合,增强肿瘤细胞特异性摄取。
23187通过Ca²⁺途径促进EVs分泌,实现TNF-α的深层递送。
免疫微环境重塑:DCs成熟、M1巨噬细胞极化、CD8+ T细胞浸润增加,Tregs减少。
协同效应:VSVG(膜融合)+ A23187(EVs分泌)+ TNF-α(凋亡/免疫激活)联合作用显著抑制肿瘤生长和转移。
这些数据为“冷肿瘤”免疫治疗提供了实验依据,突出了工程化纳米囊泡的多功能协同作用。
本文中的所有流式数据均由层浪生物Longcyte®流式细胞仪获取。
